
Du ser det i reklam varje dag: krämer och lotioner för att minska rynkor, färgämnen för att eliminera grått hår och botemedel för att minska muskel- och ledvärk. Tillsammans med dessa ytnivåförändringar påverkar åldrandet också kroppens inre fysiologi, inklusive ökad inflammation i hjärnan (Czirr & Wyss-Coray, 2012), degeneration i näthinnan (Hoh Kam et al, 2010) och permeabilitet av tarmväggarna (Ma et al, 1992). Många industrier är byggda med målet att vända tecken på åldrande. Men finns det något sätt att motverka effekterna av åldrande i kroppen på ett djupare plan än att färga håret? En grupp forskare föreslår ett unikt sätt att vrida tillbaka klockan på åldranderelaterade konsekvenser i hjärnan med hjälp av fekal mikrobiotaöverföring (FMT; Parker et al., 2022).
FMT använder principerna för parabios (Se en verklig Knowing Neurons-artikel här.!) för att byta tarmmikrobiomer, definierade som helheten av bakterier och mikroorganismer som lever i den friska tarmen (Sommer et al, 2013), mellan åldrade och unga möss. För att testa sin hypotes att användning av FMT för att förändra tarmmikrobiomet förändrar inflammation i hjärnan och kroppen, använde Parker och kollegor en musmodell med 3 månader gamla möss (unga möss) och 24 månader gamla möss (åldrade möss) ). Innan experimentet startade samlade forskarna först fekalt material för att fastställa baslinjen för unga och åldrade musmikrobiomer. Efteråt fick mössen antibiotika i tre dagar för att minska bakterierna i deras tarmar. Efter antibiotikabehandlingen tog forskarna ytterligare ett fekalt prov. Efter dessa inledande steg utfördes två omgångar av FMT, där flytande avföring gavs nasalt och möss placerades i burar innehållande avföring enligt deras experimentgrupp. De experimentella grupperna i denna studie var åldrade möss som fick FMT från unga möss och unga möss som fick FMT från åldrade möss, medan kontrollgrupperna var unga möss som fick FMT från andra unga möss eller en icke-fekal kontrolllösning (kallad unga kontrollmöss) och åldrade möss som får FMT från andra åldrade möss eller en icke-fekal kontrolllösning (kallas åldrade kontrollmöss). Efter FMT samlades avföring upp fem dagar och två veckor senare. Denna experimentella design gjorde det möjligt för utredarna att studera hur åldern på tarmmikrobiomet påverkar processer i hjärnan, näthinnan och tarmarna.
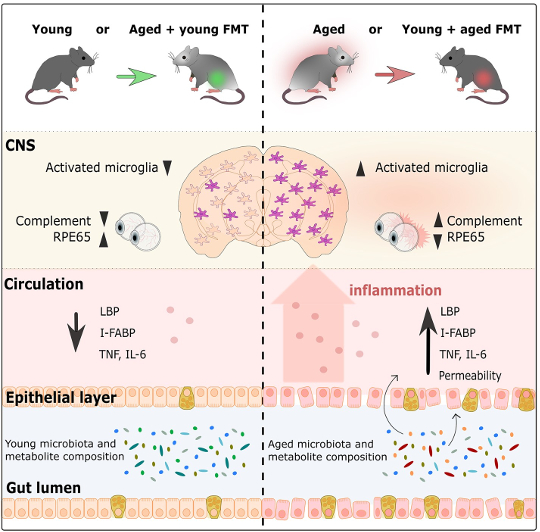
Grafiskt sammandrag från Parker et al., 2022
...att infundera en åldrad mus med en ung mikrobiom häver immunsvaret som ses med åldern.
Forskare undersökte först hur FMT påverkar det inflammatoriska svaret av mikroglia, hjärnans bosatta immunceller, i cortex och corpus callosum (ett enormt knippe av neuroner som tillåter de två sidorna av hjärnan att kommunicera med varandra) (Heneka et al, 2019) ; Erny et al, 2015). Åldrade kontrollmöss hade mer aktiverade mikroglia än unga kontrollmöss, vilket återspeglar processen med normalt åldrande. Men åldrade möss med unga mikrobiomer hade mycket mindre mikrogliaaktivering än åldrade kontrollmöss. Överraskande nog var mikroglia-svaret ganska likt det som observerades hos unga kontrollmöss. Samma mönster visades också i motsatt riktning, eftersom unga möss med åldrade mikrobiomer hade mycket mer mikrogliaaktivering än unga kontrollmöss, snarare liknande nivåerna av aktivering som ses i åldrade kontrollmöss. Detta visar att mikrobiomets ålder påverkar immunsvaret i hjärnan, och att infusion av en åldrad mus med en ung mikrobiom upphäver immunsvaret som ses med åldern. På samma sätt accelererar att ge en ung mus en åldrad mikrobiom ålderns effekt på hjärnans immunceller.
...mikrobiomet påverkar åldersrelaterade processer i näthinnan...
Förutom att undersöka hjärnan undersökte forskarna också hur tarmmikrobiomets ålder påverkar näthinnan. I allmänhet visades det att jämfört med unga möss hade åldrade möss ökad inflammation i näthinnan. Men efter FMT hade åldrade möss med unga mikrobiomer näthinneinflammationsnivåer liknande de hos unga kontrollmöss. I linje med fynden i hjärnan gällde också det motsatta. Unga möss med åldrade mikrobiomer hade retinal inflammation som liknade åldrade kontrollmöss. Tarmmikrobiomet påverkar även en annan del av det visuella systemet: fotoreceptorernas förmåga att regenerera i näthinnan med hjälp av proteinet RPE65, vars produktion också är känt att minska med åldern (Cai et al, 2009). Hos åldrade möss med unga mikrobiomer fanns en ökad mängd av RPE65-proteinet jämfört med åldrade kontrollmöss. Faktum är att dessa proteinnivåer liknade nivåerna hos unga möss. Dessutom hade unga möss med åldrade mikrobiomer mycket mindre RPE65 än unga kontrollmöss, med proteinnivåer jämförbara med nivåer som ses i åldrade möss. Sammantaget visar detta att mikrobiomet påverkar åldersrelaterade processer i näthinnan, med unga mikrobiomer som vänder och åldrade mikrobiomer påskyndar processer associerade med åldrande.
Ett annat viktigt organ, tarmarna, är inte heller förskonade från effekterna av åldrandet: cellskiktet som bildar tarmväggen blir med tiden läckande (Cui et al, 2019; Thevaranjan et al, 2017). Under loppet av åldrandet minskar stabiliteten i tarmväggen och blir mer permeabel, vilket gör att bakterier kan läcka ut i periferin, vilket i sin tur ökar den totala inflammationen (Cui et al, 2019; Thevaranjan et al, 2017). I den här studien visade forskarna att mikrobiomets ålder påverkar tarmväggarnas stabilitet. Hos åldrade möss med ett ungt mikrobiom var tarmarna mindre läckande än åldrade kontrollmöss. Faktum är att tarmpermeabiliteten hos äldre möss med en ung mikrobiom liknade permeabiliteten hos unga möss. Åldrade möss med unga mikrobiomer hade också nivåer av inflammation och tecken på bakterier i blodet liknande unga möss. Återigen betedde sig tarmarna hos unga möss med åldrade mikrobiomer på samma sätt som åldrade möss med åldrade mikrobiomer genom att ha en läckare tarm och mer inflammation än unga möss med unga mikrobiomer. Dessa resultat stöder hypotesen att åldrade mikrobiomer bidrar till ökningen av tarmpermeabiliteten, vilket underlättar en ökning av inflammation genom att låta bakterier läcka in i blodomloppet. Viktigt är att införa en ung mikrobiom genom FMT vänder dessa åldersrelaterade effekter.
…åldern för tarmens mikrobiom påverkar funktionerna i hjärnan, näthinnan och tarmen.
Studiens resultat visar att tarmens mikrobiomålder påverkar funktionerna i hjärnan, näthinnan och tarmen. Men hur skiljer sig unga och åldrade mikrobiomer från varandra? För att besvara denna fråga sekvenserade forskarna DNA från mikrobiomet som hittades i de fekala proverna som samlades in under experimentets gång. Den unga och åldrade mikrobiomen hade redan olika genetiska sammansättningar innan FMT inträffade, men FMT förändrade avsevärt den genetiska sammansättningen av båda mikrobiomen. Unga möss med åldrade mikrobiomer hade en mycket liknande sammansättning som åldrade kontrollmöss, medan den genetiska sammansättningen hos åldrade möss med unga mikrobiomer skilde sig från åldrade kontrollmöss och skilde sig också från unga möss med unga mikrobiomer – de var någonstans mittemellan. Åldrade kontrollmöss och unga möss med åldrade mikrobiomer hade mestadels bakterier från Oscillibacter och Prevotella släkte, Firmicutes filum och Lactobacillus johnsonii arter, medan unga kontrollmöss och åldrade möss med unga mikrobiomer hade bakterier mestadels från Bifidobacterium, Ackermansia, Parabacteroides, Clostridiumoch Enterococcus grupper. När man undersökte den potentiella orsaken till dessa åldersrelaterade förändringar fann forskarna att vägar involverade i lipid- och vitaminproduktion (som är beroende av metaboliter som produceras av bakterier), skilde sig åt mellan åldrade och unga mikrobiomer. Det finns en nackdel med denna observation – förändringarna i mängden av olika typer av bakterier och deras potentiella funktion i tarmen var inte långvarig, eftersom det inte fanns några stora skillnader mellan mikrobiomsammansättningen två veckor efter FMT.
Sammantaget visade denna studie att tarmmikrobiomet påverkar åldersrelaterade processer i hjärnan, ögat och tarmen. Åldrade mikrobiomer, oberoende av mottagarmusens ålder, ledde till mer inflammation i hjärnan, näthinnan och tarmarna, mindre regenereringspotential i fotoreceptorer i näthinnan och fler bakterier som läckte ut ur tarmarna. Å andra sidan, införandet av unga mikrobiomer till åldrade möss vände dessa åldrande effekter. Detta kan bero på skillnaderna i bakteriesammansättningen hos åldrade och unga mikrobiomer, och den effekt som dessa förändringar kan ha på vägar som är ansvariga för lipid- och vitaminproduktion. En fråga som inte togs upp i denna studie var hur mikrobiomåldern påverkar kognitiva prestanda, eftersom varken kontrollmöss eller FMT-möss betedde sig annorlunda i beteendeminnetester. Framtida forskning bör också fokusera på denna fråga eftersom kognition och minne är kända för att minska med åldern, och att förstå mikrobiomets roll i åldersrelaterad kognitiv försämring skulle kunna ge viktig insikt i möjliga biologiska grunder. En annan riktning som framtida forskningsfrågor bör följa skulle vara kostens inverkan på tarmmikrobiomets sammansättning. Tidigare studier har visat att olika dieter förändrar typerna av mikrober i tarmen både på kort sikt (David et al., 2014) och på lång sikt (Wu et al., 2011). Om förändringar i kosten kan förändra sammansättningen av tarmmikrobiomet, vad händer om det kan minska dessa tecken på åldrande i hjärnan, näthinnan och tarmarna också?
Om förändringar i kosten kan förändra sammansättningen av tarmmikrobiomet, vad händer om det kan minska dessa tecken på åldrande i hjärnan, näthinnan och tarmarna också?
Om Författarna
Skriven av Holly Korthas, Illustrerad av Federica Raguseo, Redigerad av Johanna Popp, Sarah Wadeoch Lauren Wagner
Referensprojekt
Cai, X., Conley, SM, & Naash, MI (2009). RPE65: roll i den visuella cykeln, mänsklig retinal sjukdom och genterapi. Oftalmisk genetik, 30(2), 57-62. https://doi.org/10.1080/13816810802626399
Cui, H., Tang, D., Garside, GB, Zeng, T., Wang, Y., Tao, Z., Zhang, L., & Tao, S. (2019). Wnt-signalering medierar den åldrande-inducerade differentieringsförsämringen av intestinala stamceller. Stamcellsrecensioner och -rapporter, 15(3), 448-455. https://doi.org/10.1007/s12015-019-09880-9
Czirr, E., & Wyss-Coray, T. (2012). Immunologin av neurodegeneration. Journal of Clinical Investigation, 122(4), 1156-1163. https://doi.org/10.1172/JCI58656
David, L., Maurice, C., Carmody, R. et al. Dieten förändrar snabbt och reproducerbart den mänskliga tarmens mikrobiomet. Natur 505, 559-563 (2014). https://doi-org.proxy.library.georgetown.edu/10.1038/nature12820
Erny, D., Hrab? de Angelis, AL, Jaitin, D., Wieghofer, P., Staszewski, O., David, E., Keren-Shaul, H., Mahlakoiv, T., Jakobshagen, K., Buch, T., Schwierzeck, V. ., Utermöhlen, O., Chun, E., Garrett, WS, McCoy, KD, Diefenbach, A., Staeheli, P., Stecher, B., Amit, I., & Prinz, M. (2015). Värdmikrobiota kontrollerar ständigt mognad och funktion av mikroglia i CNS. Nature Neuroscience, 18(7), 965-977. https://doi.org/10.1038/nn.4030
Heneka MT (2019). Microglia står i centrum för neurodegenerativ sjukdom. Naturrecensioner. Immunologi, 19(2), 79-80. https://doi.org/10.1038/s41577-018-0112-5
Hoh Kam, J., Lenassi, E., & Jeffery, G. (2010). Se åldrande ögon: olika platser för amyloid Beta-ackumulering i den åldrande musens näthinna och uppreglering av makrofager. PloS One, 5(10), e13127. https://doi.org/10.1371/journal.pone.0013127
Ma, TY, Hollander, D., Dadufalza, V., & Krugliak, P. (1992). Effekt av åldrande och kalorirestriktion på intestinal permeabilitet. Experimentell Gerontologi, 27(3), 321-333. https://doi.org/10.1016/0531-5565(92)90059-9
Parker, A., Romano, S., Ansorge, R., Aboelnour, A., Le Gall, G., Savva, GM, Pontifex, MG, Telatin, A., Baker, D., Jones, E., Vauzour , D., Rudder, S., Blackshaw, LA, Jeffery, G., & Carding, SR (2022). Överföring av avföring av mikrobiota mellan unga och gamla möss vänder på kännetecknen för den åldrande tarmen, ögat och hjärnan. microbiome, 10(1), 68.
https://doi.org/10.1186/s40168-022-01243-w
Sommer, F., & Bäckhed, F. (2013). Tarmmikrobiotan - mästare i värdutveckling och fysiologi. Naturrecensioner. Mikrobiologi, 11(4), 227-238. https://doi.org/10.1038/nrmicro2974
Thevaranjan, N., Puchta, A., Schulz, C., Naidoo, A., Szamosi, JC, Verschoor, CP, Loukov, D., Schenck, LP, Jury, J., Foley, KP, Schertzer, JD, Larché, MJ, Davidson, DJ, Verdú, EF, Surette, MG, & Bowdish, DME (2017). Åldersassocierad mikrobiell dysbios främjar intestinal permeabilitet, systemisk inflammation och makrofagdysfunktion. Cell värd & mikrob, 21(4), 455–466.e4. https://doi.org/10.1016/j.chom.2017.03.002
Wu, GD, Chen, J., Hoffmann, C., Bittinger, K., Chen, YY, Keilbaugh, SA, Bewtra, M., Knights, D., Walters, WA, Knight, R., Sinha, R. , Gilroy, E., Gupta, K., Baldassano, R., Nessel, L., Li, H., Bushman, FD, & Lewis, JD (2011). Koppla samman långsiktiga kostmönster med tarmmikrobiella enterotyper. Vetenskap (New York, NY), 334(6052), 105-108. https://doi-org.proxy.library.georgetown.edu/10.1126/science.1208344
Denna artikel publicerades ursprungligen på Att veta neuroner






















